A bélflóránk természetes támogatása bio folyékony gomba kivonatokkal
Minden betegség a belekben kezdődik
Az emberi bélrendszerben élő mikrobák összességét, akár önálló szervnek is tekinthetjük, éppolyan létfontosságúak, mint a szívünk, az agyunk, májunk, óriási hatással vannak az egész emberi szervezet működésére.
- A bélflóra összetétele nagy hatással van az egész szervezet működésére, különösen az immunrendszerére, de kihat az agyműködésre, és a testsúlyra is.
- A tudósok régóta tudják, hogy a bélrendszerben egy sűrű neuronhálózat helyezkedik el, amely „második agyként” jelentősen befolyásolja a test működését. Akár az érzelmeinkre is hathat a különböző hormonok előállításával.
- Elhízott egereken és embereken kimutatták, hogy bélflórájuk olyan törzseket tartalmaz, amelyek több energiát vonnak ki a táplálékból, mint a sovány egerek és emberek bélflórája.

A bélrendszerben élő mikróbák nagy részét baktériumok teszik ki, de a mellettük élő élesztőgombák, vírusok, egysejtűek szintén fontos szerepet játszanak az egészségünk megőrzésében. (összefoglalóan: mikrobiom)
Különböző ártalmak hatására a bélrendszerben lévő mikrobiom egyensúly felborul, azaz a káros mikroorganizmusok kerülnek túlsúlyba a jótékony mikrobákkal szemben, ez a diszbiózis.
Az emberi – mikrobiom szimbiózis megzavarása (diszbiózis) számos krónikus betegség (autoimmun betegségek, gyulladásos bélbetegségek, IBS, asztma, Chron betegség, SIBO, elhízás, rheumatoid arthritis-ízületi gyulladás Lloyd-Price et al., 2016)
A mikrobiom egyensúlyának felborulása következtében lokális és szisztémá gyulladások alakulnak ki a szervezetben, melyek a krónikus betegségek kialakulásához vezetnek. ( Hand et al., 2016 ). Talán nem meglepő módon a vírusfertőzések kockázata nagyobb lehet ezekben a krónikus gyulladásos betegségekben.
Bélflóránk és az immunrendszer
Az immunrendszerünk 70-80%-a a bélrendszerben található.
A mikrobiómáról kimutatták, hogy jelentős szerepet játszik az immunrendszer működésében, fejlődésében. A bél-tüdő tengely kapcsán fontos szabályozó szerepe van a légúti immunrendszer működésében is, vagyis a légúti védekezésben is.
Egyre több bizonyíték utal arra, hogy a mikrobiom és a gazdaszervezet immunrendszere közötti homeosztázis megzavarása hátrányosan befolyásolhatja a vírusokkal szembeni védekezőképességet.
A vírusfertőzések a szöveteket és szerveket támadják meg, beleértve: a felső légutakat és a tüdőt (pl.: rinovírusok és influenza, COVID19), a vastagbelet (pl.: rotavírus), a májat (pl.: Hepatitis B vírus), a gerincvelőt (pl.: poliovírus), és fehérvérsejteket (pl.: HIV). Az egészséges bélflóra nincs közvetlen hatással a COVID19-re, azonban elősegíthetik az immunrendszer fokozottabb aktivitását.
Bármilyen előnyei is vannak a probiotikumoknak, nem valószínű, hogy közvetlen hatással lesznek a SARS-CoV-2 fertőzésre. Ebben a tekintetben a probiotikumok elősegíthetik az egyes COVID-19 esetekben megfigyelt mikrobióta-zavarok korrekcióját azáltal, hogy gátolják az adott opportunista baktériumok növekedését és/vagy elősegítik a hasznos baktériumok gyógyulását. Ezen túlmenően a probiotikumok fokozhatják az immunrendszer aktivitását.
Bél tüdő tengely
A mikrobiom közvetlenül kölcsönhatásban van az immunrendszerrel, és a nyirokrendszeren keresztül a tüdő szövetével. ( Mcghee és Fujihashi, 2012 ; Date és mtsai, 2017 ; Ipci és mtsai, 2017 ).
Számos tanulmány számolt be arról, hogy a bélflóra rendellenességei tüdőbetegségekkel és légúti fertőzésekkel álltak összefüggésben ( Hand et al., 2016 ; Belkaid és Harrison, 2017 ; Selber-Hnatiw et al., 2017 ; Gong és mtsai, 2018 ; Schirmer et al., 2018 ).
Egy közelmúltbeli tanulmány arról számolt be, hogy az egészséges bélflóra növelte a gazdaszervezetek influenzával szembeni rezisztenciáját, amikor halálos influenzafertőzés történt ( Zhang et al., 2020 ).
A klinikai vizsgálatok során több probiotikus törzs kombinációjáról derült ki, hogy több mint 27%-kal csökkenti a vírusos felső légúti fertőzések tüneteit. Ráadásul ez a probiotikus kombináció a 45 év felettieknél és az elhízottaknál vagy túlsúlyosaknál még hatékonyabbnak bizonyult, ami azért is figyelemre méltó, mert számos betegségnél, például a COVID esetében ők fokozottabb kockázatnak vannak kitéve.
Az egészséges bélrendszer létfontosságúnak bizonyulhat a tüdőfertőzések leküzdésében is.
A bélflóra összetételének és metabolitjainak arányának javítása pre- és probiotikumokon keresztül, potenciális stratégia lehet a COVID-19 megelőzésében és kezelésében.
Bél-agy tengely
A Nature Reviews Microbiology folyóirat 2018-ban közölte azt a kutatást, mely szerint a bélbaktériumok összetétele az emberi viselkedésre, az agyi funkciókra is hatással van.
Az immunsejtek a bél falában folyamatos kapcsolatban állnak a mikrobiommal, az itt lezajló kedvezőtlen változások pedig így az egész szervezetre hatással lesznek.
Megnő a gyulladásos bélbetegségek az elhízás, a szív- és érrendszeri betegségek, a cukorbetegség, az inzulinrezisztencia kockázata.
Egyáltalán nem mindegy, hogy hogyan táplálkozunk, hiszen ez alapvetően meghatározza a gondolkodásunkat. Így az elfogyasztott táplálékoktól akár rossz kedvünk is lehet, de jó hangulatba és lelkiállapotba is kerülhetünk, de csak akkor, ha a megfelelő táplálékokat fogyasztjuk.
A Szivárgóbél-szindróma esetén pedig különféle méreganyagok gyulladást okoznak a bélfalban, ez pedig olyan tüneteket okozhat, mint agyi köd, szorongás, depresszió, sőt akár még viselkedési problémák kialakulásához is hozzájárulhat.
Tanulmányok szerint, minél többféle baktérium található meg a bélrendszerben, annál kisebb az esélye a túlzott stressz válasz, a szorongás vagy a depresszió kialakulásának.
A probiotikus készítmények alkalmazásának akkor van értelme, ha megfelelő környezetet teremtünk a bélrendszerben a ,,jó,, baktériumok szaporodásához.
Ennek elengedhetetlen feltétele a bélnyálkahártya regenerációja, és a káros mikróbák számának csökkentése.
Ehhez elsődlegesen megfelelő perbiotikumokra van szükség.
Jó hír, hogy mikrobiomunkat egészségessé tudjuk tenni és ebben óriási szerepet játszanak a gyógygombák, melyek kiváló prebiotikumok, gyulladás csökkentő hatóanyagaik révén csökkentik a bélnyálkahártya gyulladásait, és elősegítik a regenerációját.
A gyógygombák hatása az egészséges mikrobiomra
Forrás: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5618583/
A gyógygombákat több ezer használják gyógyászati és élelmiszeripari célokra, az egészséges mikrobiomra gyakorolt hatásuk még további kutatások tárgyát képezi.
A gyógygombák jótékony tulajdonsága, hogy gazdag forrásai az alfa és béta glükánoknak, mannánoknak, hemicellulóznak, ezért kiváló prebiotikus hatásuk van.
Jelen tudományos áttekintés bizonyos gyógygomba fajok bélflórára gyakorolt jótékony hatásait foglalja össze, az exogén kórokozók gátlásán keresztül és a gazdaszervezet egészségének javításán keresztül.
A prebiotikumok elnyomják a gasztintesztinalis (GI) traktusban található endogén kórokozókat, lehetővé téve az immunrendszer fokozottabb ellenálló képességét az exogén kórokozókkal szemben.
A prebiotikumok egyúttal csökkentik olyan betegségek kialakulásának esélyét, mint a cukorbetegség, elhízás és rák.
Az oligoszacharidok és rostok a prebiotikumok fő összetevői.
A gombákban lévő béta-glükánok olyan prebiotikumok, amelyek gátolják a kórokozók szaporodását, azáltal hogy serkentik a jó bélflóra növekedését, megakadályozva ezzel az anyagcsere rendellenességek, bélgyulladás, máj és idegrendszeri rendellenességek kialakulását, növelve a szervezet energia ellátását!
A gombák bioaktív poliszacharidokat és esszenciális aminosavakat, ásványi anyagokat: kalcium, kálium, magnézium, vas, cink tartalmaznak. A gombák jelentős fehérje tartalommal rendelkeznek. A szénhidrátok a gombák szárazanyag tartalmának mintegy felét teszik ki. A gombákban lévő szénhidrátok, béta-glükánok jelentős szerepet játszanak a gyógyászati tulajdonságokban. A gombákban uralkodó ásványi anyag a kálium. Aszkorbinsav tartalom 150-300 mg/kg, riboflavin 2,6-9 mg/kg, niacin 63-83 mg/kg. Az átlagos ergoszterol tartalom 1,98 mg/g, D2 vitamin tartalom 16,88 µg/g. A gombák D2 vitamin tartalma UV sugárzással növelhető. A gombák jelentős antioxidáns hatással és fenolos összetételüknek köszönhetően a legerősebb fémkelátképző hatással rendelkeznek.
Egyes gombafajok emésztőrendszerre és bélmikrobiomra gyakorolt hatásaik
|
Gombafaj |
Hatóanyag |
Egészségügyi hatás |
Bél mikrobiomra gyakorolt hatás |
|
Grifola frondosa |
vizes frakció |
védelmet nyújt béldaganat képződése ellen [ 62 ]. |
jótékonyan befolyásolja a mikrobiom összetételt és aktivitását |
|
Ganoderma lucidum |
etanolos frakció |
A Ganoderma lucidum csökkenti az egerek elhízását a bél mikrobiom összetételének módosításával [ 64 ].
|
A GL csökkentette a Firmicutes/Bacteroidetes arányt. |
|
Hericum erinaceus |
Galaktoxiloglukán-fehérje komplex, vizes frakció |
A Hericum erinaceus rákellenes, immunmoduláló, hipolipidémiás, antioxidáns és neuroprotektív hatással rendelkezik [ 67 ]. |
A Hericum erinaceus megváltoztatja a gyomor-bél traktus mikrobiótájának összetételét és aktivitását, ami táplálkozási és egészségügyi előnyökkel jár a gazdaszervezet számára. |
|
Közönséges csiperke |
Poliszacharidok |
Antibakteriális tulajdonság [ 53 ]. |
A fehér csiperkegomba növelik a mikrobiális diverzitást és felgyorsítják a citrobacter rodentium fertőzés feloldódását egerekben. |
|
Lentinula edodes |
Lentinán, vizes frakció |
A Lentinula edodes eredetű poliszacharid megfiatalítja az egereket az immunválasz és a bélmikrobióta szempontjából [ 69 ] |
Az Lentinán megfordítja a bél mikrobióta szerkezetét, például a csökkent Firmicutes/Bacteroidetes arányt, a megnövekedett Bacteroidia, csökkent Bacillus és Betaproteobacteria, megnövekedett Bacteroidaceae, csökkent Lactobacilaceae és Alcaligenaceae arányt. |
|
Fomes fomentarius |
Poliszacharidok |
A Fomes fomentarius különféle betegségek, például dysmenorrhoea, aranyér, hólyagbántalmak, lázas betegségek, köhögés, rák és reuma kezelésére szolgál [ 70 ]. |
A bélmikrobióta szabályozásában betöltött pontos szerep még nem tisztázott jól. |
Reishi/Ganoderma lucidum
A gombák királyaként emlegetik, erős gyulladáscsökkentő hatással rendelkezik, hozzájárul a hosszú élettartamhoz, jobb immunműködéshez. Triterpén tartalma révén nyugtató hatással van az idegrendszerre. A G. lucidum összetevői kedvezőhatást gyakorolnak a bélflórára, ezért prebiotikumként működik, ezért a tulajdonságáért a poliszacharidok a felelősek. Prebiotikus hatása főleg a Bifidobakteriumok számának növelésében nyilvánul meg. A mikrobiota szabályozásán keresztül gátolja a hasnyálmirigy-gyulladást.
A Ganoderma lucidium (GL) egérkísérletes modellben csökkentette az egerek elhízását azáltal, hogy módosítja a bélmikrobióta összetételét.
A GL csökkenti a testsúlyt, a gyulladást és az inzulinrezisztenciát magas zsírtartalmú étrenddel táplált egerekben.
Az eredmények megerősítik, hogy a GL prebiotikus szerként használható a bélrendszeri dysbiosis és az elhízással összefüggő anyagcserezavarok megelőzésére elhízott egyénekben. A gombákról kimutatták, hogy a mikrobiom változása révén javítják az antioxidáns állapotot.
Chaga gomba (Hamvaskéreg gomba)
A Chagaból hagyományosan teát főznek, amelyet számos betegség kezelésére használnak, pl rák, vírusos és bakteriális fertőzések, gyomor, bélrendszeri betegségek. Csökkenti a gyomorgyulladást.
Védő hatást fejt ki az oxidatív stresszel szemben a májban.
Bizonyos állatkísérletes kutatásokban hatásosnak bizonyult vastag és végbélrák esetén, ebből kifolyólag ígéretes gombafajnak tekintik a vastagbél rák kezelésére alkalmazott gyógyszer kifejlesztésében.
Változásokat indukál a bél mikrobiotában és növeli a baktériumok számát a törzs szintjén, és a változásokat az egészséges bakteriális profil felé viszi, azaz a Bakteriodetes és Firmucutes arányt az egészséges irányba befolyásolja, ezáltal hozzájárul az egészséges anyagcseréhez és az egészséges testsúly eléréséhez.
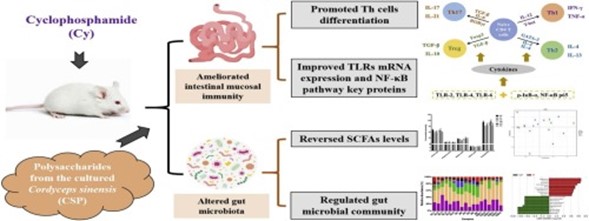
Cordyceps sinensis
Forrás: https://www.sciencedirect.com/science/article/abs/pii/S0144861720301314
Egy tanulmányban egérkísérletes modellen keresztül vizsgálták Cordyceps sinensis poliszacharidok (CSP) védő hatását ciklofoszfamid (Cy) által kiváltott bélnyálkahártya immunszuppresszióján és a mikrobiális dysbiosison keresztül.
A CSP javította a mikrobiális közösségek diverzitását és modulálta a bélmikrobióta általános szerkezetét. A taxonómia összetétel elemzése arra mutatott rá, hogy a CSP növelte a probiotikumok mennyiségét (Lactobacillus, Bifidobacterium, Bacteroides ), és csökkentte kórokozó baktériumok számát. Ezek az eredmények arra utalnak, hogy a CSP prebiotikumként képes csökkenteni a Cy mellékhatásait a bélnyálkahártya immunitására és a bél mikrobiotára.
Azaz a Cordyceps sinensis elősegíti a bélnyálkahártya regenerációját és a bélflóra egészséges összetételét.
Süngomba
A Süngombában lévő hatóanyagok hatása kettős, ugyanis egyszerre támogatják az emésztőrendszer és idegrendszer működését. Nem hiába mondják róla, hogy aki rendszeresen fogyasztja, annak acélidegzete és oroszlán elméje lesz. Buddhista szerzetesek rendszeresen fogyasztják a belőle készített teát, a meditáció előtt. Ma már tudjuk, mennyire szoros a bél és az agy között a kapcsolat.
Egy japán kutatás során a depressziót és a szorongást vizsgálták. A süngombát fogyasztó csoportban már 4 hét elteltével a páciensek depresszió és szorongás skáláján jelentős mértékű javulást tapasztaltak.
Egy másik kutatás során változókorban lévő nőket vizsgáltak négy héten keresztül. A menopauzális idegrendszeri tünetek, vagyis az ingerlékenység, a szorongás, a koncentrációs képesség gyengülése jelentős javulást mutattak a süngomba kivonat hatására, a vegetatív tünetek, például a szívdobogás csökkent. Az alvás minősége is javult.
Nem elegendő csak probiotikumokat fogyasztani. Ahhoz, hogy a probiotikus készítmények hatása megfelelően érvényesüljön, biztosítanunk kell a megfelelő perbiotikumokat és az emésztőrendszer működéséhez szükséges egyéb anyagokat.
A prebiotikumok olyan anyagok, amelyek olyan mikroorganizmusok (pl.: baktériumok és gombák) növekedését vagy hatását idézik elő, amelyek hozzájárulnak gazdaszervezetük jólétéhez [ 51 ].
Az általánosan ismert prebiotikus élelmiszerek fogyasztása szintén kedvező irányba befolyásolja a bélflórát: nyers cikória gyökér (64,6%), nyers csicsóka (31,5%), nyers pitypang zöldje (24,3%), nyers fokhagyma (17,5%) és nyers hagyma (8,6%).
A fent említetteken kívül a gombákat a prebiotikumok potenciális forrásának is tekintik, mivel különféle poliszacharidokat tartalmaznak, mint például kitint, hemicellulózt, mannánokat, α- és β-glükánokat, galaktánokat és xilánokat [ 52 ]].
Összeállította:
Szabó Nikolett
tudományos kutató
Forrás:
- Rathee S., Rathee D., Rathee D., Kumar V., Rathee P. Mushrooms as therapeutic agents. Rev. Bras. Farmacogn. 2012;22:457–474. doi: 10.1590/S0102-695X2011005000195. [CrossRef] [Google Scholar]
- Abugri D., McElhenney W.H., Willian K.R. Fatty acid profiling in selected cultivated edible and wild medicinal mushrooms in the Southern United States. J. Exp. Food Chem. 2016;2:1–7. doi: 10.4172/2472-0542.1000108. [CrossRef] [Google Scholar]
- Mhanda F.N., Kadhila-Muandingi N.P., Ueitele I.S.E. Minerals and trace elements in domesticated Namibian Ganoderma species. Afr. J. Biotechnol. 2015;14:3216–3218. doi: 10.5897/AJB2015.14573. [CrossRef] [Google Scholar]
- De Sousa V.M.C., Dos Santos E.F., Sgarbieri V.C. The importance of prebiotics in functional foods and clinical practice. Food Nutr. Sci. 2011;2:4. doi: 10.4236/fns.2011.22019. [CrossRef] [Google Scholar]
- Bhakta M., Kumar P. Mushroom polysaccharides as a potential prebiotics. Int. J. Health Sci. Res. 2013;3:77–84. doi: 10.1016/j.bcdf.2015.11.001. [CrossRef] [Google Scholar]
- Cani P.D., Delzenne N.M. The role of the gut microbiota in energy metabolism and metabolic disease. Curr. Pharm. Des. 2009;15:1546–1558. doi: 10.2174/138161209788168164. [PubMed] [CrossRef] [Google Scholar]
- Petrovska B. Protein fraction of edible Macedonian mushrooms. Eur. Food Sci. Technol. 2001;212:469–472. doi: 10.1007/s002170000285. [CrossRef] [Google Scholar]
- Batbayar S., Lee D.H., Kim H.W. Immunomodulation of fungal β-glucan in host defense signaling by dectin-1. Biomol. Ther. 2012;20:433–445. doi: 10.4062/biomolther.2012.20.5.433. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Huan G., Cai W., Xu B. Vitamin D2, ergosterol, and vitamin B2content in commercially dried mushrooms marketed in China and increased vitamin D2 content following UV-C irradiation. Int. J. Vitam. Nutr. Res. 2016;21:1–10. doi: 10.1024/0300-9831/a000294. [PubMed] [CrossRef] [Google Scholar]
- Robbins R.J. Phenolic acids in foods: An overview of analytical methodology. J. Agric. Food Chem. 2003;51:2866–2887. doi: 10.1021/jf026182t. [PubMed] [CrossRef] [Google Scholar]
- Islam T., Yu X., Xu B. Phenolic profiles, antioxidant capacities and metal chelating ability of edible mushroom commonly consumed in China. LWT Food Sci. Technol. 2016;72:423–431. doi: 10.1016/j.lwt.2016.05.005. [CrossRef] [Google Scholar]
- Rai M., Tidke G., Wasser S.P. Therapeutic potential of mushrooms. Nat. Prod. Radiance. 2005;4:246–257. [Google Scholar]
- Nahata A. Ganoderma lucidum: A potent medicinal mushroom with numerous health benefits. Pharm. Anal. Acta. 2013;4:10. doi: 10.4172/2153-2435.1000e159. [CrossRef] [Google Scholar]
- Smina T.P., Nitha B., Devasagayam T.P., Janardhanan K.K. Ganoderma lucidumtotal triterpenes induce apoptosis in MCF-7 cells and attenuate DMBA induced mammary and skin carcinomas in experimental animals. Mutat. Res. 2017;813:45–51. doi: 10.1016/j.mrgentox.2016.11.010. [PubMed] [CrossRef] [Google Scholar]
- Zeng Q., Zhou F., Lei L., Chen J., Lu J., Zhou J., Cao K., Gao L., Xia F., Ding S., et al. Ganoderma lucidumpolysaccharides protect fibroblasts against UVB-induced photoaging. Mol. Med. Rep. 2016;15:111–116. doi: 10.3892/mmr.2016.6026. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wu Y.S., Ho S.Y., Nan F.H. Ganoderma lucidumβ 1,3/1,6 glucan as an immunomodulator in inflammation induced by a high-cholesterol diet. BMC Complement. Altern. Med. 2016;16:500. doi: 10.1186/s12906-016-1476-3. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Shuhaimi Y.S., Arbakariya M., Fatimah A., Khalilah A.B., Anas A.K., Yazid A.M. Effect of Ganoderma lucidumpolysaccharides on the growth of Bifidobacterium spp. as assessed using Real-time PCR. Int. Food Res. J. 2012;19:1199–1205. [Google Scholar]
- Li K., Zhuo C., Teng C., Yua S., Wang X., Hu Y., Ren G., Yu M., Qu J. Effects of Ganoderma lucidumpolysaccharides on chronic pancreatitis and intestinal microbiota in mice. Int. J. Biol. Macromol. 2016;93:904–912. doi: 10.1016/j.ijbiomac.2016.09.029. [PubMed] [CrossRef] [Google Scholar]
- Tang X., Cai W., Xu B. Comparison of the chemical profiles and antioxidant and antidiabetic activities of extracts from two Ganoderma species (Agaricomycetes) Int. J. Med. Mushrooms. 2016;18:609–620. doi: 10.1615/IntJMedMushrooms.v18.i7.60. [PubMed] [CrossRef] [Google Scholar]
- Wang X.L., Ding Z.Y., Liu G.Q. Improved production and antitumor properties of triterpene acids from submerged culture of Ganoderma lingzhi. Molecules. 2016;21:1395. doi: 10.3390/molecules21101395. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wu H., Tang S.Z., Huang Q. Hepatoprotective effects and mechanisms of action of triterpenoids from lingzhi or reishi medicinal mushroom Ganoderma lucidum(Agaricomycetes) on α-amanitin-induced liver injury in mice. Int. J. Med. Mushrooms. 2016;18:841–850. doi: 10.1615/IntJMedMushrooms.v18.i9.80. [PubMed] [CrossRef] [Google Scholar]
- Rajasekaran M., Kalaimagal C. In vitro antioxidant activity of ethanolic extract of a medicinal mushroom, Ganoderma lucidum. J. Pharm. Sci. Res. 2011;3:1427–1433. [Google Scholar]
- Spinosa R. The chaga storey. Mycophile. 2006;47:1–8. [Google Scholar]
- Hartwell J.L. Plants Used against Cancer.Quartermain Publishing; Lawrence, MA, USA: 1982. 694p [Google Scholar]
- Hong K.B., Noh D.O., Park Y., Suh H.J. Hepatoprotective activity of water extracts from chaga medicinal mushroom, Inonotus obliquus (higher Basidiomycetes) against tert-butyl hydroperoxide induced oxidative liver injury in primary cultured rat hepatocytes. Int. J. Med. Mushrooms. 2015;17:1069–1076. doi: 10.1615/IntJMedMushrooms.v17.i11.70. [PubMed] [CrossRef] [Google Scholar]
- Kang J.H., Jang J.E., Mishra S.K., Lee H.J., Nho C.W., Shin D., Jin M., Kim M.K., Choi C., Oh S.H. Ergosterol peroxide from Chaga mushroom (Inonotus obliquus) exhibits anti-cancer activity by down-regulation of the β-catenin pathway in colorectal cancer. J. Ethnopharmacol. 2015;15:303–312. doi: 10.1016/j.jep.2015.07.030. [PubMed] [CrossRef] [Google Scholar]
- Lee H.S., Kim E.J., Kim S.H. Ethanol extract of Innotus obliquus (chaga mushroom) induces G1 cell cycle arrest in HT-29 human colon cancer cells. Nutr. Res. Pract. 2015;9:111–116. doi: 10.4162/nrp.2015.9.2.111. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Hu Y., Teng C., Yu S., Wang X., Liang J., Bai X., Dong L., Song T., Yu M., Qu J. Inonotus obliquus polysaccharide regulates gut microbiota of chronic pancreatitis in mice. AMB Express. 2017;7:39. doi: 10.1186/s13568-017-0341-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Luo K.W., Yue G.G., Ko C.H., Lee J.K., Gao S., Li L.F., Li G., Fung K.P., Leung P.C., Lau C.B. In vivo and in vitro anti-tumor and anti-metastasis effects of Coriolus versicoloraqueous extract on mouse mammary 4T1 carcinoma. Phytomedicine. 2014;21:1078–1087. doi: 10.1016/j.phymed.2014.04.020. [PubMed] [CrossRef] [Google Scholar]
- Kobayashi M., Kawashima H., Takemori K., Ito H., Murai A., Masuda S., Yamada K., Uemura D., Horio F. Ternatin, a cyclic peptide isolated from mushroom, and its derivative suppress hyperglycemia and hepatic fatty acid synthesis in spontaneously diabetic KK-A(y) mice. Biochem. Biophys. Res. Commun. 2012;427:299–304. doi: 10.1016/j.bbrc.2012.09.045. [PubMed] [CrossRef] [Google Scholar]
- Yu Z.T., Liu B., Mukherjee P., Newburg D.S. Trametes versicolorextract modifies human fecal microbiota composition in vitro. Plant Foods Hum. Nutr. 2013;68:107–112. doi: 10.1007/s11130-013-0342-4. [PubMed] [CrossRef] [Google Scholar]
- Pallav K., Dowd S.E., Villafuerte J., Yang X., Kabbani T., Hansen J., Dennis M., Leffler D.A., Newburg D.S., Kelly C.P. Effects of polysaccharopeptide from Trametes versicolorand amoxicillin on the gut microbiome of healthy volunteers. Gut Microbes. 2014;5:458–467. doi: 10.4161/gmic.29558. [PubMed] [CrossRef] [Google Scholar]
- Matijašević D., Pantić M., Rašković B., Pavlović V., Duvnjak D., Sknepnek A., Nikšić M. The antibacterial activity of Coriolus versicolormethanol extract and its effect on ultrastructural changes of Staphylococcus aureus and Salmonella Enteritidis. Front. Microbiol. 2016;7:1226. doi: 10.3389/fmicb.2016.01226. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Alonso E.N., Ferronato M.J., Gandini N.A., Fermento M.E., Obiol D.J., Lopez Romero A., Arévalo J., Villegas M.E., Facchinetti M.M., Curino A.C. Antitumoral effects of D-fraction from Grifola frondosa(maitake) mushroom in breast cancer. Nutr. Cancer. 2017;69:29–43. doi: 10.1080/01635581.2017.1247891. [PubMed] [CrossRef] [Google Scholar]
- Lin C.H., Chang C.Y., Lee K.R. Cold-water extracts of Grifola frondosaand its purified active fraction inhibit hepatocellular carcinoma in vitro and in vivo. Exp. Biol. Med. 2016;241:1374–1385. doi: 10.1177/1535370216640149. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Harhaji L.J., Mijatović S., Maksimović-Ivanić D., Stojanović I., Momcilović M., Maksimović V., Tufegdzić S., Marjanović Z., Mostarica-Stojković M., Vucinić Z., et al. Anti-tumor effect of Coriolus versicolormethanol extract against mouse B16 melanoma cells: In vitro and in vivo study. Food Chem. Toxicol. 2008;46:1825–1833. doi: 10.1016/j.fct.2008.01.027. [PubMed] [CrossRef] [Google Scholar]
- Phillip A., Green E.S.J., Voigt R.M. The gastrointestinal microbiome alcohol effects on the composition of intestinal microbiota. Alcohol. Res. 2015;37:223–236. [PMC free article] [PubMed] [Google Scholar]
- Guinane C.M., Cotter P.D. Role of the gut microbiota in health and chronic gastrointestinal disease: Understanding a hidden metabolic organ. Ther. Adv. Gastroenterol. 2013;6:295–308. doi: 10.1177/1756283X13482996. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Conlon M.A., Bird A.R. The impact of diet and lifestyle on gut microbiota and human health. Nutrients. 2014;7:17–44. doi: 10.3390/nu7010017. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Houghton D., Stewart C.J., Christopher P. Gut microbiota and lifestyle interventions in NAFLD. Int. J. Mol. Sci. 2016;17:447. doi: 10.3390/ijms17040447. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Clarke S.F., Murphy E.F., Nilaweera K. The gut microbiota and its relationship to diet and obesity new insights. Gut Microbes. 2012;3:186–202. doi: 10.4161/gmic.20168. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Finelli C., Tarantino G. Non-alcoholic fatty liver disease, diet and gut microbiota. EXCLI J. 2014;13:461–490. [PMC free article] [PubMed] [Google Scholar] Retracted
- Schuijt T.J., Lankelma J.M., Scicluna B.P., Schuijt T.J., Lankelma J.M., Scicluna B.P., de Sousa e Melo F., Roelofs J.J., de Boer J.D., Hoogendijk A.J., et al. The gut microbiota plays a protective role in the host defence against pneumococcal pneumonia. Gut. 2016;65:575–583. doi: 10.1136/gutjnl-2015-309728. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Vyas U., Ranganathan N. Probiotics, prebiotics, and synbiotics: Gut and beyond. Gastroenterol. Res. Pract. 2012:872716. doi: 10.1155/2012/872716. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Jandhyala S.M., Talukdar R., Subramanyam C., Vuyyuru H., Sasikala M., Reddy D.N. Role of the normal gut microbiota. World J. Gastroenterol. 2015;21:8787–8803. doi: 10.3748/wjg.v21.i29.8787. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Le Blanc J.G., Milani C., de Giori G.S. Bacteria as vitamin suppliers to their host: A gut microbiota perspective. Curr. Opin. Biotechnol. 2013;24:160–168. doi: 10.1016/j.copbio.2012.08.005. [PubMed] [CrossRef] [Google Scholar]
- Kang M.J., Kim H.G., Kim J.S., Oh D.G., Um Y.J., Seo C.S., Han J.W., Cho H.J., Kim G.H., Jeong T.C., et al. The effect of gut microbiota on drug metabolism. Expert Opin. Drug Metab. Toxicol. 2013;9:1295–1308. doi: 10.1517/17425255.2013.807798. [PubMed] [CrossRef] [Google Scholar]
- Wu H.J., Wu E. The role of gut microbiota in immune homeostasis and autoimmunity. Gut Microbes. 2012;3:4–14. doi: 10.4161/gmic.19320. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Okumura R., Takeda K. Maintenance of gut homeostasis by the mucosal immune system. Proc. Jpn. Acad. Ser. B Phys. Biol. Sci. 2016;92:423–435. doi: 10.2183/pjab.92.423. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Goto Y., Ivanov I.I. Intestinal epithelial cells as mediators of the commensal–host immune crosstalk. Immunol. Cell Biol. 2013;91:204–214. doi: 10.1038/icb.2012.80. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Hutkins R.W., Krumbeck J.A., Bindels L.B., Cani P.D., Fahey G., Jr., Goh Y.J., Hamaker B., Martens E.C., Mills D.A., Rastal R.A., et al. Prebiotics: Why definitions matter. Curr. Opin. Biotechnol. 2016;37:1–7. doi: 10.1016/j.copbio.2015.09.001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Singdevsachan S.K., Mishra P.A.J., Baliyarsingh B., Tayung K., Thatoi H. Mushroom polysaccharides as potential prebiotics with their antitumor and immunomodulating properties: A review. Bioact. Carbohydr. Diet. Fibre. 2015;7:1–14. doi: 10.1016/j.bcdf.2015.11.001. [CrossRef] [Google Scholar]
- Varshney J., Ooi J.H., Jayarao B.M. White button mushrooms increase microbial diversity and accelerate the resolution of Citrobacterrodentium infection in mice. J. Nutr. 2013;143:526–532. doi: 10.3945/jn.112.171355. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Meneses M.E., Carrera M.D., Torres N. Hypocholesterolemic properties and prebiotic effects of Mexican Ganoderma lucidumin C57BL/6 Mice. PLoS ONE. 2016;11:e0159631. doi: 10.1371/journal.pone.0159631. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Giannenasa I., Tsalie E.B., Chronisc E.F. Consumption of Agaricus bisporusmushroom affects the performance, intestinal microbiota composition and morphology, and antioxidant status of turkey poults. Anim. Feed Sci. Technol. 2011;165:218–229. doi: 10.1016/j.anifeedsci.2011.03.002. [CrossRef] [Google Scholar]
- Geurts L., Neyrinck A.M., Delzenne N.M. Gut microbiota controls adipose tissue expansion, gut barrier and glucose metabolism: Novel insights into molecular targets and interventions using prebiotics. Benef. Microbes. 2014;5:3–17. doi: 10.3920/BM2012.0065. [PubMed] [CrossRef] [Google Scholar]
- Xu X., Zhang X. Lentinula edodes-derived polysaccharide alters the spatial structure of gut microbiota in mice. PLoS ONE. 2015;10:e0115037. doi: 10.1371/journal.pone.0115037. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Saman P., Chaiongkarn A., Moonmangmee S., Sukcharoen J., Kuancha C., Fungsin B. Evaluation of prebiotic property in edible mushrooms. Biol. Chem. Res. 2016;3:75–85. [Google Scholar]
- Pandeya D.R., Souza R.D., Rahman M.M. Host-microbial interaction in the mammalian intestine and their metabolic role inside. Biomed. Res. 2011;2:1–8. [Google Scholar]
- Gerritsen J., Smidt H., Rijkers G.T., de Vos W.M. Intestinal microbiota in human health and disease: The impact of probiotics. Genes Nutr. 2011;6:209–240. doi: 10.1007/s12263-011-0229-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Khoruts A., Dicksved J., Jansson J.K., Sadowsky M.J. Changes in the composition of the human fecal microbiome after bacteriotherapy for recurrent Clostridium difficile-associated diarrhea. J. Clin. Gastroenterol. 2010;44:354–360. doi: 10.1097/MCG.0b013e3181c87e02. [PubMed] [CrossRef] [Google Scholar]
- Hetland G., Dag M., Eide M., Haugen M.H., Mirlashari M.R., Paulsen J.E. The Agaricus blazei-based mushroom extract, andosan, protects against intestinal tumorigenesis in the A/J Min/+ mouse. PLoS ONE. 2016;11:e0167754. doi: 10.1371/journal.pone.0167754. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Huang H.Y., Korivi M., Chaing Y.Y., Chien T.Y., Tsai Y.C. Pleurotus tuber-regium polysaccharides attenuate hyperglycemia and oxidative stress in experimental diabetic rats. J. Evid. Based Complement. Altern. Med. 2012:856381. doi: 10.1155/2012/856381. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Chang C.J., Lin C.S., Lu C.C., Martel J., Ko Y.F., Ojcius D.M., Tseng S.F., Wu T.R., Chen Y.Y., Young J.D., et al. Ganoderma lucidumreduces obesity in mice by modulating the composition of the gut microbiota. Nat. Commun. 2015;6:7489. doi: 10.1038/ncomms8489. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Stamets P.E. Integrative Fungal Solutions for Protecting Bees and Overcoming Colony Collapse Disorder (CCD): Methods and Compositions. 20140220150 A1. U.S. Patent. 2014 Aug 7;
- Kim H., Han S., Lee C., Lee K., Hong D. Compositions Containing Polysaccharides from Phellinus linteusand Methods for Treating Diabetes Mellitus Using Same. 6,809,084 B1. U.S. Patent. 2004 Oct 26;
- Kuo H.C., Lu C.C., Shen C.H., Tung S.Y., Hsieh M.C., Lee K.C., Lee L.Y., Chen C.C., Teng C.C., Huang W.S., et al. Hericium erinaceus mycelium and its isolated erinacine A protection from MPTP-induced neurotoxicity through the ER stress, triggering an apoptosis cascade. J. Transl. Med. 2016;14:78. doi: 10.1186/s12967-016-0831-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar] Retracted
- Lindequist U., Niedermeyer T.H.J., Julich W.D. The pharmacological potential of mushrooms. Evid. Based Complement. Altern. Med. 2005;2:285–299. doi: 10.1093/ecam/neh107. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Xu X., Yang J., Ning Z. Lentinula edodes-derived polysaccharide rejuvenates mice in terms of immune responses and gut microbiota. Food Funct. 2015;6:2653–2663. doi: 10.1039/C5FO00689A. [PubMed] [CrossRef] [Google Scholar]
- Grienke U., Zoll M., Peintner U. European medicinal polypores—A modern view on traditional uses. J. Ethnopharmacol. 2014;154:564–583. doi: 10.1016/j.jep.2014.04.030. [PubMed] [CrossRef] [Google Scholar]
- Lemieszek M., Rzeski W. Anticancer properties of polysaccharides isolated from fungi of the Basidiomycetes class. Contemp. Oncol. 2012;16:285–289. doi: 10.5114/wo.2012.30055. [PMC free article] [PubMed] [CrossRef] [Google Scholar]